Marknadsnyheter
BioArctics partner Eisai presenterar resultat från fas 3-studien Clarity AD med lecanemab på Alzheimerkonferensen CTAD
Stockholm, den 30 november 2022 – BioArctic AB:s (publ) (Nasdaq Stockholm: BIOA B) partner Eisai meddelande idag att resultaten från den stora globala registreringsgrundande fas 3-studien Clarity AD av lecanemab (BAN2401), presenterats vid 2022 års CTAD-konferens (Clinical Trials on Alzheimer’s Disease), i San Francisco, Kalifornien och digitalt. Lecanemab är en antikropp under utveckling, som är riktad mot protofibriller av amyloid beta (Aβ) för behandling av mild kognitiv störning (MCI) och mild Alzheimers sjukdom med bekräftad amyloidpatologi i hjärnan (gemensamt benämnt tidig Alzheimers sjukdom).
Sammanfattning av presentationerna under den vetenskapliga sessionen med lecanemab
Studiedesign
Fas 3-studien Clarity AD var en global registreringsgrundande placebokontrollerad, dubbelblind, randomiserad, parallellgruppsstudie av 1795 personer med tidig Alzheimers sjukdom (lecanemabgruppen: 898, placebogruppen: 897) som genomfördes på 235 kliniker i Nordamerika, Europa och Asien. Studiedeltagarna fördelades jämnt i två grupper som antingen fick en infusion av placebo eller lecanemab 10 mg/kg varannan vecka. Deltagarna i grupperna fördelades jämnt vad gäller klinisk subgrupp (mild kognitiv störning på grund av Alzheimers sjukdom (MCI) eller mild Alzheimers sjukdom), eventuell godkänd symptomatisk medicinering vid studiestart (t.ex. acetylkolinesterashämmare, memantin eller båda), ApoE4-status och geografisk region. Urvalskriterierna tillät patienter med ett brett spektrum av andra vanligt förekommande sjukdomar och behandlingar såsom hypertoni, diabetes, hjärtsjukdomar, övervikt, njursjukdom och blodförtunnande läkemedel. Som ett resultat av Eisais rekryteringsstrategi för Clarity AD-studien var 4,5% och 22,5% av de randomiserade deltagarna i USA afro-amerikanska respektive latinamerikanska personer.
Det primära effektmåttet var förändring från baslinjen vid 18 månader enligt CDR-SB[1] (Clinical Dementia Rating Sum of Boxes), en kognitiv och funktionell skala. Viktiga sekundära effektmått var förändringen från baslinjen vid 18 månader i amyloid-PET (i Centiloids), ADAS-Cog14[2] (AD Assessment Scale – Cognitive Subscale 14), ADCOMS[3] (AD Composite Score) och ADCS MCI-ADL[4] (AD Cooperative Study-Activities of Daily Living Scale for Mild Cognitive Impairment). Dessutom utvärderades förändringar i hjärnan över tid gällande tau-patologi mätt med tau-PET (n=257) och biomarkörer relaterade till Alzheimer-patologi uppmätt via CSF (ryggvätska)(n=281) i för patienterna valfria substudier.
Effekt
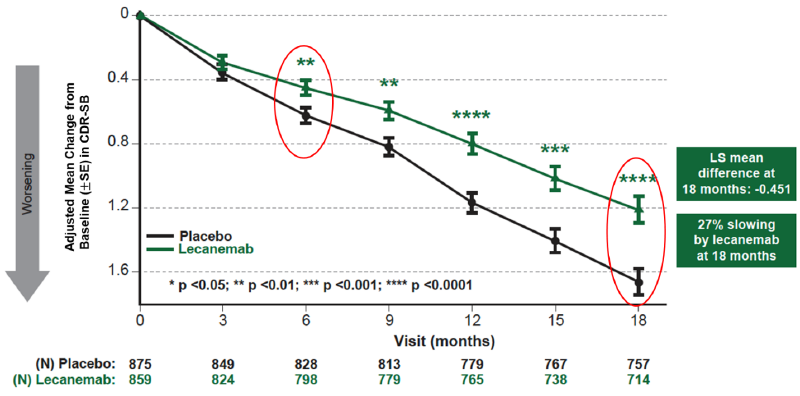
Genomsnittlig förändring från baslinjen av det primära effektmåttet CDR-SB vid 18 månader var 1,21 och 1,66 för lecanemab- respektive placebogruppen. Resultaten visade med statistiskt högt signifikans att behandling med lecanemab minskade den kliniska försämringen på den globala kognitiva och funktionella skalan, jämfört med placebo efter 18 månader med -0,45 (95% konfidensintervall (CI): -0,67, -0,23; P=0,00005), vilket motsvarar en inbromsning på 27%. Behandlingen visade statistiskt högt signifikanta förändringar i CDR-SB från baslinjen jämfört med placebo (samtliga p-värden <0,01) redan vid sex månader (skillnad: -0,17 [95% KI: -0,29, -0,05]; P<0,01), effektens storlek ökade stegvis över tid i absoluta tal vid alla mättillfällen (var tredje månad)(Figur 1).
Alla sekundära effektmått visade också statistiskt högt signifikanta resultat jämfört med placebo (P<0,001). I substudien av amyloid-PET visade behandling med lecanemab statistiskt signifikant minskning av de amyloida placken vid samtliga tidpunkter, med början vid 3 månader. Genomsnittlig förändring mätt i centiloid efter 18 månader var -55,5 och 3,6 för lecanemab- respektive placebogruppen (genomsnittlig skillnad: -59,1 [95% CI: -62,6, -55,6]; P<0,00001). Lecanemab bromsade försämringen i kognitiv funktion med 26% på ADAS-Cog14 efter 18 månader (genomsnittlig skillnad: -1,44 [95% CI: -2,27, -0,61]; P=0,00065). På ADCOMS-skalan bromsade lecanemab sjukdomsprogressionen med 24% efter 18 månader (genomsnittlig skillnad: -0,050 [95 % CI: -0,074, -0,027; P=0,00002]). Lecanemab bromsade försämringen av dagliga aktiviteter (skalan ADCS MCI-ADL) med 37% efter 18 månader (genomsnittlig skillnad: 2,016 [95% CI: 1,208, 2,823]; P<0,00001). Dessutom visade den primära stratifierade analysen konsistenta resultat i CDR-SB, ADAS-Cog14 och ADCS MCI-ADL vid 18 månaders behandling med lecanemab för alla subgrupper avseende sjukdomsstadier (mild kognitiv störning på grund av Alzheimers sjukdom (MCI) och mild Alzheimers sjukdom), ApoE4-status (icke-bärare och bärare), användning av godkänd symptomatisk Alzheimerbehandling eller ej samt regioner (Nordamerika, Europa och Asien).

Figur 1. Det primära effektmåttet CDR-SB (förändring vid 18 månader)
Säkerhet
De vanligaste biverkningarna (>10%) i lecanemab-gruppen var infusionsreaktioner (lecanemab: 26,4%; placebo: 7,4%), ARIA-H (cerebrala mikroblödningar, cerebrala makroblödningar och ytliga järninlagringar; lecanemab: 17,3%; placebo: 9,0%), ARIA-E (svullnad/ödem; lecanemab: 12,6%; placebo: 1,7%), huvudvärk (lecanemab: 11,1%; placebo: 8,1%) och fall (lecanemab: 10,4%; placebo: 9,6%). Infusionsreaktionerna var i stort sett milda till måttliga (grad 1-2: 96%) och inträffade i samband med den första dosen (75%).
Under studiens gång inträffade dödsfall hos 0,7% och 0,8% av deltagarna i lecanemab- respektive placebogruppen och inga dödsfall var relaterade till lecanemab eller inträffade in samband med ARIA under den 18 månader långa dubbelblinda studieperiod. 14,0% av deltagarna i lecanemab-gruppen och 11,3% av deltagarna i placebogruppen upplevde allvarliga biverkningar. Behandlingsrelaterade biverkningar inträffade hos 88,9 % och 81,9 % av deltagarna i lecanemab- respektive placebogruppen. Behandlingsrelaterade biverkningar som ledde till avbruten behandling inträffade hos 6,9% och 2,9% av deltagarna i lecanemab- respektive placebogruppen.
Sammantaget var lecanemabs ARIA-incidensprofil i enlighet med förväntningarna, baserat på Fas 2b-resultaten. Fall med ARIA-E var till stor del radiografiskt milda till måttliga (91% av de som hade ARIA-E), asymtomatiska (78% av de som hade ARIA-E), inträffade inom de första 3 månaderna av behandlingen (71% av de som hade ARIA-E) och försvann inom 4 månader efter upptäckt (81% av de som hade ARIA-E). Hos de 2,8% av de lecanemab-behandlade försökspersonerna som fick symtomatisk ARIA-E var de vanligaste rapporterade symtomen huvudvärk, synstörningar och förvirring. Incidensen av symtomatisk ARIA-H var 0,7% i lecanemab-gruppen och 0,2% i placebogruppen. För de som bara hade ARIA-H (och inte också fick ARIA-E) var incidensen likartad mellan lecanemabgruppen (8,8%) och placebogruppen (7,6%). ARIA-E och ARIA-H var mindre vanliga hos personer som inte är bärare av ApoE4 genen, jämfört med bärare av genen, med högre frekvens hos homozygota bärare jämfört med heterozygota bärare. I huvudstudien och den efterföljande öppna förlängningsstudien var andelen dödsfall med en samtidig större blödning i hjärnan 0,1% i både placebogruppen (1/897) och lecanemab-gruppen (2/1608). De två fallen med lecanemab inträffade i den öppna förlängningsstudien. I båda fallen fanns andra betydelsefulla sjukdomar och riskfaktorer, inklusive blodförtunnande läkemedel, som bidrog till den större blödningen i hjärnan eller död. Enligt Eisais bedömning kan dödsfallen därför inte hänföras till lecanemab.
Biomarkörer
Biomarkörer för amyloid, tau och neurodegeneration relaterade till behandling med lecanemab mättes via bildavläsning, plasma och CSF. Amyloid-biomarkörer i CSF och plasma visade tidig och bibehållen tillbakagång av Aβ 42/40-förhållandet vid lecanemab-behandling. Genomsnittlig amyloid-PET var 22,99 centiloid vid 18 månaders behandling med lecanemab, vilket var under tröskelvärdet för amyloidpositivitet på 30 centiloid. Tau-biomarkörer visade att borttagande av amyloid förbättrade p-tau (p-tau181) i CSF och plasma. Tau-förändringarna sker nedströms om amyloid-förändringarna under sjukdomsprocessen vid Alzheimers sjukdom. Dessutom visade tau-PET långsammare tau-ackumulering i tinningloben och ett förbättrat totalt tau (t-tau) med lecanemab-behandling jämfört med placebo. Vad gäller neurodegenerativa biomarkörer förbättrade lecanemab GFAP (glial fibrillary acidic protein) en markör för astrocytaktivering och neurogranin i CSF (en markör för synaptisk skada) normaliserades av behandling. Däremot sågs ingen signifikant förändring av NFL (neurofilament light chains) i CSF eller plasma mellan lecanemab och placebo.
Resultatens betydelse
Alzheimers sjukdom är en progressiv neurologisk sjukdom som allvarligt påverkar människor som lever med sjukdomen liksom deras nära och kära. Med en globalt växande åldrande befolkning har Alzheimers sjukdom blivit en viktig fråga för samhället och sjukvården. Nya behandlingar som påverkar den underliggande sjukdomen behövs. Behandlingsmålen för tidig Alzheimers sjukdom är att varaktigt påverka kognitionen, hur väl en person hanterar dagliga aktiviteter och psykiska symtom, att bibehålla patienters självständighet längre genom att bromsa utvecklingen av sjukdomen och att förbättra eller bibehålla livskvaliteten.
I Clarity AD-studien visade lecanemab konsistenta resultat över flera kognitions- och funktionsskalor, samt subgrupper (ras, etnicitet, komorbiditeter). Behandling med lecanemab visade 31% lägre risk att fortskrida till nästa sjukdomsstadium enligt CDR-skalan (Hazard Ratio: 0,69). En analys av lutningen av kurvan baserat på data för CDR-SB extrapolerat till 30 månader visade att det tar 25,5 månader för lecanemab att nå samma nivå som placebo når vid 18 månader. Detta tyder på en 7,5 månaders långsammare sjukdomsutveckling. Modellsimuleringar baserat på Fas 2b-studiedata tyder på att lecanemab kan bromsa sjukdomens progression med 2,5-3,1 år och har potential att hjälpa människor att stanna i de tidigare stadierna av Alzheimers sjukdom längre. Dessutom bibehölls den hälsorelaterad livskvaliten i större grad och grad av ökad belastning på vårdgivare minskade med mellan 23-56%. Samstämmigheten av data sett till kognition och funktion, sjukdomsprogression, hälsorelaterad livskvalitet och upplevd börda för vårdgivare visar att behandling med lecanemab kan ge meningsfulla effekter för patienter, vårdgivare, läkare och samhälle.
Eisai ansvarar för utvecklingen av lecanemab och regulatoriska interaktioner globalt. De kommer att direktsända den vetenskapliga sessionen med lecanemab-presentationer på CTAD via investerarsektionen på Eisai Co., Ltd:s webbplats. Innehållet kommer även att finnas tillgängligt i en bandad version i efterhand.
—
Detta pressmeddelande berör en läkemedelskandidat under utveckling och avser inte att förmedla några slutsatser gällande effekt och säkerhet. Det finns ingen garanti för att denna läkemedelskandidat kommer att erhålla godkännande av relevanta myndigheter.
Denna information är sådan information som BioArctic AB (publ) är skyldigt att offentliggöra enligt EU:s marknadsmissbruksförordning. Informationen lämnades, genom nedanstående kontaktpersoners försorg, för offentliggörande den 30 november 2022, kl. 01.50 CET.
För mer information, vänligen kontakta
Gunilla Osswald, vd, BioArctic AB
E-post: gunilla.osswald@bioarctic.se
Tel: +46 8 695 69 30
Oskar Bosson, VP Communications and Investor Relations
E-mail: oskar.bosson@bioarctic.se
Tel: +46 704 10 71 80
Om Clarity AD
|
Studiens titel |
A Study to Confirm Safety and Efficacy of Lecanemab in Participants With Early Alzheimer’s Disease (Clarity AD) |
|
Studiepopulation |
1 795 deltagare med mild kognitiv störning (MCI) och mild Alzheimers sjukdom (gemensamt benämnt tidig Alzheimers sjukdom) med bekräftad amyloidpatologi i hjärnan i en global studie. Ytterligare 111 deltagare har inkluderats i Kina där studien pågår |
|
Behandling |
10 mg/kg lecanemab eller placebo varannan vecka |
|
Behandlingslängd |
18 månader |
|
Geografier |
Japan, USA, Europa, Kina, Sydkorea, Kanada, Australien, Singapore |
|
Primärt effektmått |
Förändring från baslinjen i CDR-SB-poängen efter 18 månaders behandling |
|
Sekundära effektmått |
Förändring från baslinjen efter 18 månaders behandling av: |
|
Analys |
Effektanalysen utfördes i en modifierad intention-to-treat-population på 1734 försökspersoner (859 i lecanemab-gruppen och 875 i placebo-gruppen). Säkerhetsanalysen utfördes på alla 1795 randomiserade deltagare (lecanemab-gruppen: 898, placebogruppen: 897). |
Om lecanemab (BAN2401)
Lecanemab är en humaniserad monoklonal antikropp för Alzheimers sjukdom under utveckling, som är resultatet av ett strategiskt forskningssamarbete mellan BioArctic och Eisai. Lecanemab binder selektivt till, neutraliserar och eliminerar de lösliga toxiska aggregaten av Aβ (protofibriller) som anses medverka i den neurodegenerativa processen i Alzheimers sjukdom. Lecanemab har därför potentialen att kunna ha effekt på sjukdomspatologin och bromsa sjukdomsförloppet. Lecanemab är för närvarande den enda anti-Aβ-antikroppen i sen utvecklingsfas för behandling av tidig Alzheimers sjukdom utan dostitrering, vilket möjliggör full effektnivå av behandling från start.
Den öppna förlängningsstudien av Clarity AD pågår för att ytterligare utvärdera säkerheten och effekten av lecanemab och behandlingen påbörjades efter avslutad huvudstudie. Vidare pågår fas 3-studien AHEAD 3-45 för individer med preklinisk (asymtomatisk) Alzheimers sjukdom, vilket innebär att de kliniskt sett är normala, men har medelhöga eller förhöjda nivåer av Aβ i hjärnan. AHEAD 3-45-programmet bedrivs som offentlig-privat samverkan mellan med Alzheimer’s Clinical Trials Consortium (ACTC), finansierat av United States National Institute on Aging som är en del av National Institutes of Health, och Eisai. 2021 valde DIAN-TU-konsortiet, som leds av Washington University School of Medicine i St. Louis, USA, lecanemab till Tau NexGen-studien. Det är en klinisk studie för individer med dominant ärftlig Alzheimers sjukdom. Lecanemab ges som anti-amyloid-bakgrundsbehandling i kombination med olika behandlingar riktade mot tau. Vidare har Eisai genomfört en fas 1-studie för subkutan dosering av lecanemab och den subkutana formuleringen utvärderas just nu i den öppna förlängningsstudien av Clarity AD.
I juli 2022 accepterade den amerikanska läkemedelsmyndigheten, FDA, registreringsansökan för lecanemab under ett accelererat förfarande (Accelerated Approval Pathway) och beviljade en prioriterad granskning (Priority Review). Datumet när ett besked gällande registreringsansökan senast kommer att ges (ett så kallat PDUFA-datum) fastställdes till den 6 januari 2023 (Prescription Drug User Fee Action date). FDA har godkänt att Clarity AD kan tjäna som den bekräftande studien för att säkerställa den kliniska nyttan av lecanemab. I syfte att så snart som möjligt säkra ett fullständigt FDA-godkännande för lecanemab, lämnade Eisai in registreringsansökan via FDA:s accelererade förfarande så att myndigheten kan slutföra sin granskning av alla lecanemab-data, med undantag för data från den bekräftande Clarity AD-studien. Eisai inledde i mars 2022 en inlämning av ansökningsdata för lecanemab, med undantag av data från Clarity AD-studien, till den japanska hälsovårdsmyndigheten Pharmaceuticals and Medical Devices Agency (PMDA) enligt processen ”prior assessment consultation”. Eisai kommer att diskutera resultaten från Clarity AD med regulatoriska myndigheter i USA, Japan och EU, med målet att ansökan om fullständigt godkännande i USA, och ansökningar om marknadsföringstillstånd i Japan och EU ska lämnas in senast under det första kvartalet 2023.
Om samarbetet mellan BioArctic och Eisai
BioArctic har sedan 2005 ett långsiktigt samarbete med Eisai kring utveckling och kommersialisering av läkemedel för behandling av Alzheimers sjukdom. De viktigaste avtalen är utvecklings- och kommersialiseringsavtalet avseende antikroppen lecanemab som ingicks i december 2007 och utvecklings- och kommersialiseringsavtalet avseende antikroppen BAN2401 back-up för Alzheimers sjukdom som ingicks i maj 2015. I mars 2014 ingick Eisai och Biogen ett gemensamt utvecklings- och kommersialiseringsavtal som innefattar lecanemab. Eisai ansvarar för den kliniska utvecklingen, ansökan om marknadsgodkännande och kommersialisering av produkterna för Alzheimers sjukdom. BioArctic har rätt att kommersialisera lecanemab i Norden under vissa förutsättningar och förbereder för närvarande kommersialisering i Norden tillsammans med Eisai. BioArctic har inga utvecklingskostnader för lecanemab i Alzheimers sjukdom och har rätt till ersättning i samband med inlämning av ansökningar till regulatoriska myndigheter, godkännanden och försäljningsmilstolpar, samt royalty på global försäljning.
Om BioArctic AB
BioArctic AB (publ) är ett svenskt forskningsbaserat biofarmabolag med fokus på sjukdomsmodifierande behandlingar för neurodegenerativa sjukdomar, såsom Alzheimers sjukdom, Parkinsons sjukdom och ALS. BioArctic fokuserar på innovativa behandlingar inom områden med stort medicinskt behov. Bolaget grundades 2003 baserat på innovativ forskning vid Uppsala universitet. Samarbeten med universitet är av stor vikt för bolaget tillsammans med dess strategiskt viktiga globala partner Eisai inom Alzheimers sjukdom. Projektportföljen är en kombination av fullt finansierade projekt som drivs i partnerskap med globala läkemedelsbolag samt innovativa egna projekt med stor marknads- och utlicensieringspotential. BioArctics B-aktie är noterad på Nasdaq Stockholm Mid Cap (kortnamn: BIOA B). För ytterligare information, besök gärna www.bioarctic.se.
[1] CDR-SB är en numerisk skala som används för att kvantifiera olika svårighetsgrad av symtom på demens. Baserat på intervjuer av personer som lever med Alzheimers sjukdom och familj/vårdgivare bedömer kvalificerad vårdpersonal kognitiv och funktionell förmåga inom sex områden: minne, orientering, bedömningsförmåga och problemlösning, sociala funktioner, hem och fritid och personlig omvårdnad. Den totala poängen för de sex områdena är poängen för CDR-SB. Skalan används också för att utvärdera effekten av terapeutiska läkemedel som riktar sig mot tidiga stadier av Alzheimers sjukdom
[2] ADAS-cog är det vanligaste kognitiva effektmåttet som används i kliniska prövningar av Alzheimers sjukdom över hela världen. ADAS-cog14 består av 14 dimensioner t.ex. språkförmåga, förståelse av talat språk, återgivande av instruktioner, förmåga (eller problem) att hitta ord, följa uppmaningar, namnge objekt, konstruera figurer, återgivande av ord, orientering, igenkännande av ord och har använts i kliniska studier vid tidiga stadier av Alzheimer sjukdom, inklusive mild kognitiv störning.
[3] ADCOMS-skalan är utvecklad av Eisai och kombinerar delar från ADAS-cog-skalan för att bedöma kognitiva funktioner och delar från MMSE- och CDR-skalorna för att utvärdera svårighetsgraden av demens och möjliggöra upptäckt även av små förändringar i kliniska funktioner vid tidiga symtom och förändringar i minnet.
[4] ADCS-MCI-ADL bedömer förmågan hos i individer med mild kognitiv störning avseende aktiviteter i det dagliga livet (ADL), baserat på 24 frågor till patientens partner om nuvarande förmågor i det dagliga livet.
Marknadsnyheter
Eisai påbörjar stegvis ansökan till FDA för subkutan underhållsbehandling med Leqembi® (lecanemab-irmb)
Stockholm, den 15 maj 2024 – BioArctic AB:s (publ) (Nasdaq Stockholm: BIOA B) partner Eisai meddelade idag att de påbörjat en stegvis ansökan till amerikanska läkemedelsverket (FDA) om marknadsgodkännande (Biologics License Application (BLA)) av lecanemab för veckovis subkutan underhållsbehandling med en autoinjektor. Ansökan påbörjades efter att doseringsformen beviljats snabbspårsstatus, så kallad Fast Track designation, av FDA. I USA är Leqembi, som är varumärkesnamnet för lecanemab, godkänt för behandling av Alzheimers sjukdom hos patienter med mild kognitiv störning eller mild Alzheimers sjukdom, gemensamt benämnt tidig Alzheimers sjukdom.
Leqembi är godkänt för intravenös administrering som utförs varannan vecka, vanligtvis på sjukvårdsinrättningar. Subkutan administrering går även snabbare än den intravenösa behandlingen. Detta gör att behandlingen blir lättare för patienter och deras vårdpartners och kan minska behovet av sjukhusbesök och omvårdnad jämfört med intravenös administration. Samtidigt blir det enklare för patienter att fortsätta behandlingen.
Alzheimers sjukdom är en pågående process som långsamt skadar neuronerna i hjärnan och som börjar före och fortsätter efter avlägsnandet av amyloid beta (Aβ)-plack, som är ett kännetecken för sjukdomen. Tillgängliga data antyder att tidig och kontinuerlig behandling kan förlänga patientnyttan även efter det att placket avlägsnats från hjärnan. Om ansökan godkänns av FDA skulle patienter som avslutat den inledande fasen, med intravenös behandling varannan vecka, kunna behandlas en gång i veckan med 360 mg lecanemab via av en subkutan autoinjektor för att upprätthålla en effektiv koncentration av läkemedlet. Elimineringen av skadliga protofibriller[i] av Aβ, som kan fortsätta att skada hjärnan även efter det att Aβ-placket avlägsnats, kan då upprätthållas. Ansökan baseras på data från den öppna förlängningsdelen av fas 3-studien Clarity AD och modellering av observerade data.
Leqembi är nu godkänt i USA, Japan och Kina, och ansökningar om marknadsgodkännande har lämnats in i EU, Australien, Brasilien, Kanada, Hongkong, Storbritannien, Indien, Israel, Ryssland, Saudiarabien, Sydkorea, Taiwan, Singapore och Schweiz. Eisai lämnade i mars 2024 in en tilläggsansökan om marknadsgodkännande (sBLA) till FDA för mindre frekvent intravenös underhållsbehandling månatligen med Leqembi.
Eisai ansvarar för utvecklingen och regulatoriska ansökningar avseende Leqembi globalt, och samarbetar med Biogen avseende marknadsföring och kommersialisering av produkten, där Eisai är den slutgiltiga beslutsfattaren. BioArctic har rättigheter att kommersialisera lecanemab i de nordiska länderna och för närvarande förbereder BioArctic och Eisai en gemensam kommersialisering i dessa länder i väntan på europeiskt godkännande.
—
Denna information är sådan information som BioArctic AB (publ) är skyldigt att offentliggöra enligt EU:s marknadsmissbruksförordning. Informationen lämnades, genom nedanstående kontaktpersoners försorg, för offentliggörande den 15 maj 2024, kl. 01.30 CET.
För ytterligare information, vänligen kontakta:
Oskar Bosson, VP Communications and Investor Relations
E-post: oskar.bosson@bioarctic.se
Telefon: 070 410 71 80
Jiang Millington, Director Corporate Communication and Social Media
E-post: jiang.millington@bioarctic.se
Telefon: 079 33 99 166
Om lecanemab (generiskt namn, varumärkesnamn i USA, Japan och Kina: Leqembi®)
Lecanemab (Leqembi) är resultatet av ett strategiskt forskningssamarbete mellan BioArctic och Eisai. Lecanemab är en humaniserad IgG1 (immunglobulingamma 1) monoklonal antikropp riktad mot aggregerade lösliga och olösliga former av amyloid beta (Aβ). Lecanemab är godkänt i USA, Japan och Kina med följande indikation:
- USA: För behandling av Alzheimers sjukdom. Behandling bör inledas hos patienter med mild kognitiv störning eller mild Alzheimers sjukdom. Förskrivningsinformationen i USA kan läsas här (engelska).
- Japan: För att bromsa sjukdomsförloppet av mild kognitiv störning och mild Alzheimers sjukdom
- Kina: För behandling av mild kognitiv störning eller mild demens på grund av Alzheimers sjukdom
Lecanemab godkändes baserat på fas 3-data från den stora globala kliniska studien Clarity AD, där det primära effektmåttet och samtliga sekundära effektmått uppnåddes med statistiskt signifikanta resultat. I november 2022 presenterades resultaten från Clarity AD-studien vid Alzheimer-kongressen Clinical Trials on Alzheimer’s Disease (CTAD) 2022 och publicerades samtidigt i den vetenskapliga tidskriften The New England Journal of Medicine.
Eisai har också lämnat in ansökningar för marknadsgodkännande av lecanemab i 14 länder och regioner, inklusive EU.
Eisai har genomfört en fas 1-studie för subkutan dosering av lecanemab och en subkutan formulering utvärderas just nu i den öppna förlängningsstudien av Clarity AD. Underhållsbehandling har studerats som en del den öppna förlängningsstudien av lecanemabs fas 2b-studie.
Sedan juli 2020 pågår Eisais fas 3-studie AHEAD 3-45 för individer med preklinisk (asymtomatisk) Alzheimers sjukdom, vilket innebär att de kliniskt sett är normala, men har medelhöga eller förhöjda nivåer av Aβ i hjärnan. AHEAD 3-45-programmet bedrivs som offentlig-privat samverkan mellan med Alzheimer’s Clinical Trials Consortium (ACTC), som tillhandahåller infrastruktur för akademiska kliniska prövningar av Alzheimers sjukdom och relaterade demenssjukdomar i USA, finansierat av United States National Institute on Aging som är en del av National Institutes of Health, och Eisai. Sedan januari 2022 pågår Tau NexGen-studien för individer med dominant ärftlig Alzheimers sjukdom där lecanemab ges som anti-amyloid-bakgrundsbehandling. Tau NexGen är en klinisk studie som bedrivs av konsortiet Dominantly Inherited Alzheimer Network Trials Unit (DIAN-TU), under ledning av Washington University School of Medicine i St. Louis, USA.
Om samarbetet mellan BioArctic och Eisai
BioArctic har sedan 2005 ett långsiktigt samarbete med Eisai kring utveckling och kommersialisering av läkemedel för behandling av Alzheimers sjukdom. De viktigaste avtalen är utvecklings- och kommersialiseringsavtalet avseende antikroppen lecanemab som ingicks 2007 och utvecklings- och kommersialiseringsavtalet avseende antikroppen Leqembi back-up för Alzheimers sjukdom som ingicks 2015. 2014 ingick Eisai och Biogen ett gemensamt utvecklings- och kommersialiseringsavtal som innefattar lecanemab. Eisai ansvarar för den kliniska utvecklingen, ansökan om marknadsgodkännande och kommersialisering av produkterna för Alzheimers sjukdom. BioArctic har rätt att kommersialisera lecanemab i Norden och för närvarande förbereder Eisai och BioArctic en gemensam kommersialisering i regionen. BioArctic har inga utvecklingskostnader för lecanemab inom Alzheimers sjukdom och har rätt till betalningar i samband med myndighetsgodkännanden och försäljningsmilstolpar samt royalties på den globala försäljningen.
Om BioArctic AB
BioArctic AB (publ) är ett svenskt forskningsbaserat biofarmabolag med fokus på läkemedel som kan fördröja eller stoppa sjukdomsförloppet av neurodegenerativa sjukdomar. Företaget ligger bakom Leqembi® (lecanemab) – världens första läkemedel som bevisat bromsar sjukdomsutvecklingen och minskar den kognitiva försämringen vid tidig Alzheimers sjukdom. Leqembi har utvecklats i samarbete med BioArctics partner Eisai, som ansvarar för kommersialisering och regulatoriska processer globalt. Utöver Leqembi har BioArctic en bred forskningsportfölj med antikroppar mot Parkinsons sjukdom och ALS samt ytterligare projekt mot Alzheimers sjukdom. I flera av projekten används bolagets egenutvecklade teknologiplattfrom BrainTransporter™ som hjälper till att förbättra transporten av antikroppar in i hjärnan. BioArctics B-aktie (BIOA B) är noterad på Nasdaq Stockholm Large Cap. För ytterligare information, besök www.bioarctic.com.
[i] Protofibriller tros bidra till den hjärnskada som uppstår i samband med Alzheimers sjukdom och anses vara den mest skadliga formen av proteinet amyloid beta (Aβ), som har en primär roll i den kognitiva försämringen som är förknippad med denna progressiva, svåra sjukdom.ii Protofibriller orsakar skador på nervceller i hjärnan, som i sin tur kan påverka kognitiv funktion negativt via flera mekanismer, vilket inte bara ökar uppbyggnaden av olösliga Aβ-plack utan också ökar direkta skador på hjärnans cellmembran och kopplingarna som överför signaler mellan nervceller eller nervceller och andra celler. Man tror att minskningen av protofibriller kan förhindra utvecklingen av Alzheimers sjukdom genom att minska skador på nervceller i hjärnan och kognitiv dysfunktion.iii
ii Amin L, Harris DA. Aβ receptors specifically recognize molecular features displayed by fibril ends and neurotoxic oligomers. Nat Commun. 2021;12:3451. doi:10.1038/s41467-021-23507-z
iii Ono K, Tsuji M. Protofibrils of Amyloid-β are Important Targets of a Disease-Modifying Approach for Alzheimer’s Disease. Int J Mol Sci. 2020;21(3):952. doi: 10.3390/ijms21030952. PMID: 32023927; PMCID: PMC7037706.
Marknadsnyheter
Kallelse till årsstämma i Refine Group AB (publ)
Refine Group AB (publ), 559026-0963 (”Bolaget”), håller årsstämma torsdagen den 13 juni 2024 kl. 13.00 i Bolagets lokaler på adress c/o L26, Luntmakargatan 26 i Stockholm. Inpassering och registrering börjar kl. 12.45.
Rätt att delta vid stämman
Aktieägare som önskar delta i bolagsstämman ska:
- dels vara införd som aktieägare i den av Euroclear Sweden AB (”Euroclear”) förda aktieboken den 4 juni 2024, alternativt, om aktierna är förvaltarregistrerade, begära att förvaltaren rösträttsregistrerar aktierna senast den 7 juni 2024,
- dels ha anmält sitt deltagande till Bolaget enligt anvisningarna under rubriken ”Anmälan” senast den 7 juni 2024.
Anmälan
Anmälan kan ske med brev till Refine Group AB (publ), Att. Christer Karlsson, c/o L26, Luntmakargatan 26, 111 37 Stockholm eller via e-post till christer@refinegroup.com. Anmälan ska innehålla uppgift om aktieägarens fullständiga namn eller företagsnamn, person- eller organisationsnummer, adress, telefonnummer samt, i förekommande fall, det antal biträden (högst två) som avses medföras vid bolagsstämman.
Aktieägare som inte önskar delta vid stämman fysiskt kan utöva sin rösträtt vid stämman genom ombud med en skriftlig, undertecknad och daterad fullmakt. Om fullmakten utfärdas av en juridisk person ska en kopia av registreringsbevis eller motsvarande behörighetshandling för den juridiska personen bifogas.
För att underlätta inpasseringen vid stämman bör fullmakter, registreringsbevis och andra behörighetshandlingar vara Bolaget tillhanda på Bolagets adress Refine Group AB (publ), Att. Christer Karlsson, c/o L26, Luntmakargatan 26, 111 37 Stockholm eller via e-post till christer@refinegroup.com senast den 7 juni 2024. Observera att anmälan om deltagande vid stämman ska ske även om aktieägaren önskar utöva sin rösträtt vid stämman genom ombud. Inskickad fullmakt gäller inte som anmälan till stämman. Ett fullmaktsformulär finns tillgängligt på Bolagets webbplats (http://www.refinegroup.com/).
Förvaltarregistrerade aktier
Aktieägare som låtit förvaltarregistrera sina aktier genom bank eller annan förvaltare måste hos förvaltaren begära att föras in i aktieboken hos Euroclear för att kunna delta i bolagsstämman (rösträttsregistrering). Som anges ovan måste förvaltaren ha genomfört rösträttsregistreringen hos Euroclear senast den 7 juni 2024. Aktieägaren måste därför kontakta sin förvaltare i god tid före denna dag och rösträttsregistrera sina aktier i enlighet med förvaltarens instruktioner.
Personuppgifter
Personuppgifter som hämtas från aktieboken, anmälan om deltagande vid stämman och uppgifter om ombud kommer att användas för registrering, upprättande av röstlängd för stämman och, i förekommande fall, stämmoprotokoll. För information om hur personuppgifter behandlas i samband med stämman hänvisas till den integritetspolicy som finns tillgänglig på Euroclears webbplats (https://www.euroclear.com/dam/ESw/Legal/Integritetspolicy-bolagsstammor-svenska.pdf).
Förslag till dagordning
- Val av ordförande vid stämman
- Upprättande och godkännande av röstlängd
- Godkännande av dagordning
- Val av en eller två justeringsmän
- Prövande av om stämman blivit behörigen sammankallad
- Framläggande av årsredovisningen och revisionsberättelse samt koncernredovisning och koncernrevisionsberättelse
- Beslut om följande:
- fastställande av resultaträkningen och balansräkningen samt koncernresultaträkning och koncernbalansräkning.
- dispositioner beträffande Bolagets vinst eller förlust enligt den fastställda balansräkningen, och
- ansvarsfrihet åt styrelseledamöterna och verkställande direktören
- Fastställande av antalet styrelseledamöter och revisorer
- Fastställande av arvoden till styrelsen och revisorerna
- Val till styrelsen och val av revisor
- Beslut om bemyndigande för styrelsen att besluta om emissioner av aktier, teckningsoptioner och/eller konvertibler
- Beslut om godkännande av styrelsens beslut om emission av aktier
- Beslut om riktad emission av aktier till Molcap Growth AB
- Beslut om riktad emission av aktier till Thoren Tillväxt AB och NELAB INVEST AB
- Stämmans avslutande
Beslutsförslag
Punkt 1: Val av ordförande vid stämman
Aktieägare som representerar cirka 27 procent av aktierna och rösterna i Bolaget (”Förslagsställarna”) föreslår att advokat Philip Rämsell utses till ordförande vid stämman.
Punkt 7(b): Beslut om disposition av Bolagets vinst eller förlust enligt den fastställda balansräkningen
Styrelsen föreslår att ingen utdelning lämnas för räkenskapsåret 2023 och att de medel som enligt Bolagets balansräkning står till bolagsstämmans förfogande disponeras enligt styrelsens förslag i årsredovisningen för räkenskapsåret 2023.
Punkt 8 – 10: Fastställande av antalet styrelseledamöter och revisorer, fastställande av arvoden till styrelsen och revisorerna samt val till styrelsen och val av revisor
Förslagsställarna avser att återkomma, senast i samband med årsstämman, med förslag avseende antalet styrelseledamöter och styrelsesuppleanter, arvode åt styrelsen och val av styrelse och styrelseordförande.
Förslagsställarna föreslår att arvodet till revisorn ska utgå enligt av Bolaget godkänd räkning.
Förslagsställarna föreslår att den auktoriserade revisorn Andreas Folke omväljs till Bolagets revisor för tiden intill slutet av nästa årsstämma.
Punkt 11: Beslut om bemyndigande för styrelsen att besluta om emission av aktier, teckningsoptioner och/eller konvertibler
Styrelsen föreslår att stämman beslutar om bemyndigande för styrelsen att inom ramen för gällande bolagsordning vid ett eller flera tillfällen under tiden fram till nästa årsstämma besluta om emissioner av aktier, konvertibler och/eller teckningsoptioner mot kontant betalning, med bestämmelse om apport eller kvittning eller eljest med villkor samt att därvid kunna avvika från aktieägarnas företrädesrätt. I den mån emission sker med avvikelse från aktieägarnas företrädesrätt ska emissionen ske på marknadsmässiga villkor, med förbehåll för marknadsmässig emissionsrabatt i förekommande fall. Syftet med bemyndigandet och skälen till eventuell avvikelse från aktieägarnas företrädesrätt är att möjliggöra anskaffning av kapital för förvärv av bolag, eller delar av bolag, och för Bolagets rörelse.
Styrelsen eller den styrelsen utser bemyndigas att vidta de mindre justeringar i detta beslut som kan komma att vara nödvändiga i samband med registrering hos Bolagsverket.
För giltigt beslut krävs att beslutet biträds av aktieägare med minst två tredjedelar av såväl de avgivna rösterna som de aktier som är företrädda vid årsstämman.
Punkt 12: Beslut om godkännande av styrelsens beslut om emission av aktier
Styrelsen föreslår att stämman beslutar att godkänna styrelsens beslut från den 7 maj 2024 om emission av högst 1 263 872 aktier på följande villkor:
- Bolagets aktiekapital ska ökas med högst 631 936 kronor genom nyemission av högst 1 263 872 aktier.
- Rätt att teckna aktierna ska, med avvikelse från aktieägarnas företrädesrätt, tillkomma David Wallinder, Svenska Open Workspace AB och Christian Johansson Trading i Täby AB.
- Överteckning kan inte ske.
- Teckningskursen ska uppgå till 1,622 kronor per aktie. Teckningskursen har fastställts utifrån förhandlingar på armlängds avstånd med på förhand vidtalade investerare och bedöms motsvara marknadsvärdet för Bolagets aktie. Skillnaden mellan teckningskursen och aktiernas kvotvärde ska tillskjutas Bolagets fria överkursfond.
- Teckning av aktierna ska ske på särskild teckningslista senast inom 14 dagar från emissionsbeslutet. Styrelsen ska ha rätt att förlänga tiden för teckning.
- Tecknade aktier ska betalas kontant senast 30 dagar från emissionsbeslutet. Styrelsen ska ha rätt att förlänga tiden för betalning.
- De nya aktierna ska medföra rätt till utdelning första gången på den avstämningsdag för utdelning som infaller närmast efter det att emissionen har registrerats vid Bolagsverket och aktierna har blivit införda i den av Euroclear Sweden AB förda aktieboken.
- Skälen för avvikelse från aktieägarnas företrädesrätt är att (i) refinansiera befintlig skuld genom att Bolagets dotterbolag Refine Group Holding AB (publ) upptar ny kredit från Swedbank, och (ii) skapa förutsättningar för att åstadkomma en för Bolaget ändamålsenlig kapitalstruktur, vilket skapar förutsättningar för framtida investeringar i koncernbolag för nordisk expansion. Styrelsen har övervägt möjligheten att istället för nyemissionen anskaffa kapital genom en företrädesemission, men har konstaterat att ett sådant alternativ skulle innebära att Bolaget inte skulle kunna erhålla krediten eller refinansiera den befintliga skulden inom en för Bolaget ändamålsenlig tidshorisont eftersom krediten inte skulle erhållas och refinansieringen av den befintliga skulden inte skulle kunna genomföras förrän företrädesemissionen slutförts eller över huvud taget. Bolaget bedömer vidare att en företrädesemission under rådande volatila marknadsförutsättningar skulle medföra väsentligt högre kostnader relaterade till eventuella emissionsgarantier för att kunna säkra krediten. Mot bakgrund av detta är styrelsens samlade bedömning att skälen för att genomföra emissionen med avvikelse från aktieägarnas företrädesrätt i detta specifika fall tydligt och med tillräcklig styrka överväger skälen som motiverar huvudregeln att nyemissioner ska genomföras med aktieägarnas företrädesrätt. Emissionen ligger därför i Bolagets och samtliga aktieägares intresse.
- Bolagets verkställande direktör ska bemyndigas att vidta de smärre justeringar av ovanstående beslut som kan visa sig erforderliga i samband med registrering vid Bolagsverket eller andra formella krav.
För giltigt beslut krävs att beslutet biträds av aktieägare med minst nio tiondelar av såväl de avgivna rösterna som de aktier som är företrädda vid årsstämman.
Punkt 13: Beslut om riktad emission av aktier
Bolagets dotterbolag ECOMM Holding AB hade en skuld till I INVEST AB om 2 miljoner kronor hänförlig till förvärvet av Bolagets dotterbolag Gasoltuben Nordic AB (”Skuld 1”). I oktober 2023 överläts Skuld 1 till Bolagets aktieägare Molcap Growth AB mot 115 606 935 aktier i Bolaget. I samband med överlåtelsen av Skuld 1 genomfördes ett gäldenärsbyte från ECOMM Holding AB till Bolaget och parterna överenskom att Skuld 1 skulle regleras genom en emission av motsvarande antal aktier till Molcap Growth AB. För att fullfölja överenskommelsen föreslår styrelsen att stämman beslutar om en riktad emission av högst 578 035 aktier (omräknat efter sammanläggningen av aktier i Bolaget) på följande villkor:
- Bolagets aktiekapital ska ökas med högst 289 017,5 kronor genom nyemission av högst 578 035 aktier.
- Rätt att teckna aktierna ska, med avvikelse från aktieägarnas företrädesrätt, tillkomma Molcap Growth AB.
- Överteckning kan inte ske.
- Teckningskursen ska uppgå till 3,46 kronor per aktie. Teckningskursen har fastställts utifrån förhandlingar mellan Bolaget, I INVEST AB och den teckningsberättigade. Skillnaden mellan teckningskursen och aktiernas kvotvärde ska tillskjutas Bolagets fria överkursfond.
- Teckning av aktierna ska ske på särskild teckningslista senast inom 14 dagar från emissionsbeslutet. Styrelsen ska ha rätt att förlänga tiden för teckning.
- Tecknade aktier ska betalas genom kvittning av Skuld 1 i samband med teckning.
- De nya aktierna ska medföra rätt till utdelning första gången på den avstämningsdag för utdelning som infaller närmast efter det att emissionen har registrerats vid Bolagsverket och aktierna har blivit införda i den av Euroclear Sweden AB förda aktieboken.
- Skälen för avvikelse från aktieägarnas företrädesrätt är att uppfylla överenskommelsen med den teckningsberättigade. Mot bakgrund av detta är styrelsen bedömning att skälen för att genomföra emissionen med avvikelse från aktieägarnas företrädesrätt ligger i Bolagets och samtliga aktieägares intresse.
- Bolagets verkställande direktör ska bemyndigas att vidta de smärre justeringar av ovanstående beslut som kan visa sig erforderliga i samband med registrering vid Bolagsverket eller andra formella krav.
För giltigt beslut krävs att beslutet biträds av aktieägare med minst två tredjedelar av såväl de avgivna rösterna som de aktier som är företrädda vid årsstämman.
Punkt 14: Beslut om riktad emission av aktier
Bolagets tidigare dotterbolag Spherio AB (publ) hade en skuld till Thoren Tillväxt AB och NELAB INVEST AB om totalt cirka 2,9 miljoner kronor (”Skuld 2”). Bolaget övertog Skuld 2 i september 2023 under förutsättning att Thoren Tillväxt AB och NELAB INVEST AB åtog sig att teckna aktier i Bolaget för en teckningskurs motsvarande 20 kronor per aktie (omräknat efter sammanläggning av aktier i Bolaget) och att betala för de nyemitterade aktierna genom kvittning av Skuld 2. För att fullfölja överenskommelsen föreslår styrelsen att stämman beslutar om en riktad emission av högst 145 200 aktier på följande villkor:
- Bolagets aktiekapital ska ökas med högst 72 600 kronor genom nyemission av högst 145 200 aktier.
- Rätt att teckna aktierna ska, med avvikelse från aktieägarnas företrädesrätt, tillkomma Thoren Tillväxt AB och NELAB INVEST AB.
- Överteckning kan inte ske.
- Teckningskursen ska uppgå till 20 kronor per aktie. Teckningskursen har fastställts utifrån förhandlingar med de teckningsberättigade. Skillnaden mellan teckningskursen och aktiernas kvotvärde ska tillskjutas Bolagets fria överkursfond.
- Teckning av aktierna ska ske på särskild teckningslista senast inom 14 dagar från emissionsbeslutet. Styrelsen ska ha rätt att förlänga tiden för teckning.
- Tecknade aktier ska betalas genom kvittning av Skuld 2 i samband med teckning.
- De nya aktierna ska medföra rätt till utdelning första gången på den avstämningsdag för utdelning som infaller närmast efter det att emissionen har registrerats vid Bolagsverket och aktierna har blivit införda i den av Euroclear Sweden AB förda aktieboken.
- Skälen för avvikelse från aktieägarnas företrädesrätt är att uppfylla överenskommelsen med de teckningsberättigade. Mot bakgrund av detta är styrelsen bedömning att skälen för att genomföra emissionen med avvikelse från aktieägarnas företrädesrätt ligger i Bolagets och samtliga aktieägares intresse.
- Bolagets verkställande direktör ska bemyndigas att vidta de smärre justeringar av ovanstående beslut som kan visa sig erforderliga i samband med registrering vid Bolagsverket eller andra formella krav.
För giltigt beslut krävs att beslutet biträds av aktieägare med minst två tredjedelar av såväl de avgivna rösterna som de aktier som är företrädda vid årsstämman.
Upplysningar på stämman
Styrelsen och den verkställande direktören ska, om någon aktieägare begär det och styrelsen anser att det kan ske utan väsentlig skada för Bolaget, lämna upplysningar om förhållanden som kan inverka på bedömningen av ett ärende på dagordningen och förhållanden som kan inverka på bedömningen av Bolagets ekonomiska situation. Upplysningsplikten avser även Bolagets förhållande till annat koncernföretag, koncernredovisningen och sådana förhållanden beträffande dotterföretag som avses i föregående mening.
Handlingar
Redovisningshandlingar, revisionsberättelse, fullmaktsformulär och övriga handlingar som ska tillhandahållas inför stämman enligt aktiebolagslagen kommer att hållas tillgängliga hos Bolaget och på Bolagets webbplats (http://www.refinegroup.com/) senast tre veckor före stämman samt kommer att skickas kostnadsfritt till de aktieägare som begär det och uppger sin postadress. En sådan begäran kan skickas till Refine Group AB (publ), Att. Christer Karlsson, c/o L26, Luntmakargatan 26, 111 37 Stockholm eller via e-post till christer@refinegroup.com.
* * *
Stockholm i maj 2024
Refine Group AB (publ)
Styrelsen
För ytterligare information, vänligen kontakta:
David Wallinder, VD, Refine Group AB (publ)
Telefon: +46 73 525 08 45
E-mail: ir@refinegroup.com
Informationen i detta pressmeddelande har publicerats genom ovanstående kontaktpersons försorg, vid den tidpunkt som anges av Refines nyhetsdistributör Cision vid publiceringen av detta pressmeddelande.
Information om Refine Group
Refine är en varumärkeskoncern som skapar, utvecklar och accelererar livsstilsvarumärken inom den digitala handeln. Koncernen ska genom sitt ekosystem nå synergier genom kompetensdelning och samordning av funktioner som digital marknadsföring, logistik, distribution och produktutveckling. Koncernen är uppdelad i två affärsområden: Products och Digital Services.
Refine Groups aktie är noterad på Nasdaq First North Growth Market Stockholm under kortnamnet REFINE. Eminova Fondkommission AB är Bolagets Certified Adviser och kan nås via telefon: +46 (0)8-684 211 10 eller e-post: adviser@eminova.se.
För ytterligare information, se:www.refinegroup.com.
Marknadsnyheter
Kommuniké från årsstämma i Micro Systemation AB (publ)
Vid årsstämma i Micro Systemation AB (publ) (”MSAB”) den 14 maj 2024 fattades följande beslut.
Resultat- och balansräkningar
Årsstämman fastställde resultaträkningen och balansräkningen samt koncernresultaträkningen och koncernbalansräkningen för räkenskapsåret 2023.
Utdelning
Årsstämman beslutade, i enlighet med styrelsens förslag, om en ordinarie utdelning om 1,50 kronor per aktie, att utbetalas genom två delbetalningar. En första utbetalning om 1,00 kronor per aktie med avstämningsdag torsdagen den 16 maj 2024 och en andra utbetalning om 0,50 kronor per aktie med avstämningsdag fredagen den 15 november 2024. Med dessa avstämningsdagar beräknas Euroclear Sweden AB utbetala 1,00 kronor per aktie tisdagen den 21 maj 2024 och 0,50 kronor per aktie onsdagen den 20 november 2024.
Årsstämman beslutade även att de nya aktier som kan komma att emitteras med stöd av stämmobemyndigande ska ge rätt till utdelning från och med den dag de blivit införda i den av Euroclear förda aktieboken.
Ersättningsrapport
Årsstämman beslutade, i enlighet med styrelsens förslag, att godkänna ersättningsrapporten enligt 8 kap. 53 a § aktiebolagslagen.
Ansvarsfrihet
Årsstämman beslutade att bevilja styrelseledamöterna och de verkställande direktörerna som varit verksamma under räkenskapsåret 2023 ansvarsfrihet för förvaltningen under räkenskapsåret 2023.
Val av styrelse
Årsstämman beslutade, i enlighet med valberedningens förslag, att styrelsen ska bestå av sex ordinarie ledamöter utan suppleanter.
Årsstämman beslutade, i enlighet med valberedningens förslag, att omvälja styrelseledamöterna Fredrik Nilsson, Peter Gille, Andreas Hedskog, Jesper Kärrbrink och Charlotte Stjerngren samt att nyvälja Helena Holmgren till styrelseledamot för tiden intill slutet av nästa årsstämma. Peter Gille valdes, i enlighet med valberedningens förslag, till styrelseordförande för tiden intill slutet av nästa årsstämma.
Val av revisor
Årsstämman omvalde, i enlighet med valberedningens förslag, revisionsbolaget KPMG AB som revisor med Mattias Lötborn som huvudansvarig revisor för tiden intill slutet av årsstämman 2025.
Styrelse- och revisorsarvode
Årsstämman beslutade, i enlighet med valberedningens förslag, att styrelsearvode ska utgå med sammanlagt 1 750 000 kronor, att fördelas med 500 000 kronor till styrelsens ordförande samt 250 000 kronor till var och en av styrelsens övriga ledamöter.
Årsstämman beslutade, i enlighet med valberedningens förslag, att arvodet till bolagets revisor ska utgå enligt godkänd räkning.
Bemyndigande att besluta om nyemission
Årsstämman beslutade, i enlighet med styrelsens förslag, om bemyndigande för styrelsen att inom ramen för gällande bolagsordning, intill tiden för nästa årsstämma, vid ett eller flera tillfällen, fatta beslut om nyemission av aktier med eller utan avvikelse från aktieägarnas företrädesrätt. Det totala antalet aktier som utges genom nyemissioner enligt bemyndigandet får motsvara sammanlagt högst 10 procent av antalet aktier i bolaget, baserat på det sammanlagda antalet aktier i bolaget vid tidpunkten för årsstämman 2024.
Bemyndigande att besluta om förvärv och överlåtelse av bolagets egna aktier
Årsstämman beslutade, i enlighet med styrelsens förslag, om bemyndigande för styrelsen att, vid ett eller flera tillfällen intill nästa årsstämma, besluta om förvärv och överlåtelse av aktier av serie B i bolaget. Förvärv av aktier i bolaget får endast ske genom handel på Nasdaq Stockholm eller genom förvärvserbjudande mot kontant vederlag till bolagets samtliga aktieägare och får ske av högst så många aktier att bolagets egna innehav vid var tid ej överstiger 10 procent av samtliga aktier i bolaget.
Överlåtelse enligt bemyndigandet får ske av samtliga egna aktier som bolaget innehar vid tidpunkten för styrelsens beslut och överlåtelse av aktier på Nasdaq Stockholm får endast ske till ett pris inom det på Nasdaq Stockholm vid var tid registrerade kursintervallet. Överlåtelse av aktier får även ske utanför Nasdaq Stockholm i samband med företagsförvärv, med eller utan avvikelse från aktieägarnas företrädesrätt och med eller utan bestämmelser om apport eller kvittningsrätt. Sådan överlåtelse får ske till ett pris i pengar eller värde på erhållen egendom som motsvarar börskursen vid tiden för överlåtelsen på de aktier som överlåts med den avvikelse som styrelsen finner lämplig.
Principer för utseende av valberedning
Årsstämman beslutade, i enlighet med valberedningens förslag, om principer för utseende av valberedning samt instruktion till valberedningen.
För ytterligare information, kontakta gärna:
Peter Gille, Styrelseordförande. Tfn: +46 70 825 00 14, e-post: petgille@googlemail.com Tony Forsgren, CFO. E-post: tony.forsgren@msab.com
Om MSAB:
MSAB är världsledande inom kriminalteknik för att utvinna och analysera data i beslagtagna mobila enheter. Företaget utvecklar högkvalitativ och lättanvänd mjukvara som hjälper brottsbekämpande myndigheter, så som; polis, försvar och tull, att utföra sina uppdrag. Produkterna, som har blivit en de facto-standard för att säkra bevis i brottsutredningar, kan kompletteras med verktyg för rapportering och ett stort utbildningsutbud med certifieringar inom rättssäker kriminalteknik. Företaget betjänar kunder i mer än 100 länder över hela världen, genom egna säljkontor och via distributörer. MSAB är noterat på Nasdaq Stockholm under ticker-namnet: MSAB B. www.msab.com
Denna information lämnades, genom ovanstående kontaktpersoners försorg, för offentliggörande den 14 maj 2024 kl. 20:30.
Taggar:
-
Analys från DailyFX8 år ago
EUR/USD Flirts with Monthly Close Under 30 Year Trendline
-

 Marknadsnyheter1 år ago
Marknadsnyheter1 år agoUpptäck de bästa verktygen för att analysera Bitcoin!
-
Marknadsnyheter4 år ago
BrainCool AB (publ): erhåller bidrag (grant) om 0,9 MSEK från Vinnova för bolagets projekt inom behandling av covid-19 patienter med hög feber
-
Analys från DailyFX11 år ago
Japanese Yen Breakout or Fakeout? ZAR/JPY May Provide the Answer
-
Analys från DailyFX11 år ago
Price & Time: Key Levels to Watch in the Aftermath of NFP
-
Analys från DailyFX7 år ago
Gold Prices Falter at Resistance: Is the Bullish Run Finished?
-

 Nyheter5 år ago
Nyheter5 år agoTeknisk analys med Martin Hallström och Nils Brobacke
-
Marknadsnyheter6 år ago
Tudorza reduces exacerbations and demonstrates cardiovascular safety in COPD patients

